Agrupación y síntesis de la información: clasificación de la evidencia científica
Una vez leídos, evaluados y extraídos los datos de los estudios seleccionados (referentes a las características de los estudios, sus resultados y la valoración de la calidad), se elaboran las tablas de evidencia que sintetizan el contenido principal de cada estudio de forma esquemática y permite una comparación fácil entre los distintos estudios.
Las tablas de evidencia constituyen una visión gráfica y resumida, en forma de tabla, del conjunto de estudios seleccionados. El objetivo de las tablas de evidencia es identificar y valorar si existe variabilidad en los resultados y si ésta puede ser atribuible a distintas características de los estudios como: la naturaleza de la intervención sanitaria evaluada, las características de la población objeto de investigación o peculiaridades del diseño de los estudios.
Las tablas de evidencia permiten valorar la homogeneidad o comparabilidad de los estudios, la concordancia entre sus resultados, así como generar hipótesis explicativas de las diferencias encontradas entre los resultados de los distintos estudios.
Las tablas de evidencia permiten valorar la homogeneidad o comparabilidad de los estudios, la concordancia entre sus resultados, así como generar hipótesis explicativas de las diferencias encontradas entre los resultados de los distintos estudios.


En la Tabla 2, se puede ver un ejemplo de tabla de evidencia (procedente del artículo de Serra-Prat M et al, 1999) en la que se presentan algunas de las características de los ocho ensayos controlados y aleatorizados identificados e incluidos en el metaanálisis sobre la eficacia y seguridad del tratamiento trombolítico en el tromboembolismo pulmonar (TEP). Dicha tabla posibilita valorar la homogeneidad y la comparabilidad de los estudios, y permite destacar el limitado número de ensayos clínicos que evalúan la eficacia y la seguridad de los agentes trombolíticos en el TEP. Además, evidencia un reducido tamaño de las muestras de los estudios que comporta una baja potencia estadística y poca precisión en la estimación de la magnitud del efecto.
Tabla 2. Tabla de evidencia: tratamiento fibrinolítico en la tromboembolia pulmonar
Estudio Año |
Grupos de tratamiento a comparar |
Principales medidas de eficacia |
Media de edad (en años) |
Duración Síntomas prealeatorización |
TEP o TVP Previos |
Cirugía, trauma o inmovilización último mes |
Presencia de cáncer |
Escala de Jadad |
Mortalidad OR |
UPET 1970 |
UK (n=82) |
Angiográficas |
<50/³50 = 46/36 |
no consta |
12,2 % |
no consta |
no consta |
3 |
0,80 n.s. |
Tibbutt 1974 |
SK (n=13) |
Angiográficas |
51 |
no consta |
No consta |
76,9 % |
0 % |
3 |
0,33 n.s |
Ly 1978 |
SK (n=14) |
Angiográficas |
51 |
£2/>2 días = 11/3 |
64,3 % |
35,7 % |
7,1 % |
1 |
0,35 n.s |
Marini 1988 |
UK (3 días) (n=10) |
Gammagráficas |
52 |
3,5 días |
No consta |
no consta |
no consta |
2 |
0,51 n.s |
PIOPED |
rt-PA (n=9) |
Angiográficas |
57,7 |
inferior a 7 días |
No consta |
no consta |
no consta |
3 |
1,59 n.s |
Levine 1990 |
rt-PA (n=33) |
Gammagráficas |
61,5 |
5,9 días |
21,2 % |
no consta |
15,1 % |
1 |
2,35 n.s |
Dalla-Volta 1992 |
rt-PA (n=20) |
Angiográficas |
65,7 |
3,1 días |
40 % |
40% |
0 % |
1 |
1,67 n.s |
Goldhaver 1993 |
rt-PA (n=46) |
Ecocardiográficas |
58 |
£5/>5 días = 34/10 |
34,8 % |
17,4 % |
13 % |
2 |
0,23 n.s |
UK=uroquinasa. SK=estreptoquinasa. n=tamaño muestral. TEP=tromboembolismo pulmonar. TVP=trombosis venosa profunda. n.s=no significativo
Fuente: Serra-Prat, M.; Jovell, A.J.; Aymerich, M. (1999). "Eficacia y seguridad del tratamiento trombolítico en la tromboembolia pulmonar: metaanálisis de ensayos clínicos controlados y aleatorizados". Medicina Clínica. Barcelona. Núm. 112, págs. 685-689
Antes de sintetizar los resultados de los distintos estudios debe valorarse la comparabilidad entre ellos respecto a las características de diseño, muestra de estudio, tipo de intervención, medidas del resultado, etc., así como valorar el peso relativo de cada uno de los estudios según el tamaño de la muestra (y por lo tanto la variabilidad de las estimaciones de cada estudio) y su calidad o rigurosidad metodológica.
En la RSEC con síntesis cualitativa los resultados de los estudios primarios individuales son sintetizados pero no combinados. En la RSEC con síntesis cuantitativa los resultados de los estudios individuales se combinan por los métodos estadísticos formales del metaanálisis (ver parte II de este módulo).
 Clasificación de la evidencia científica y escalas de evidencia
Clasificación de la evidencia científica y escalas de evidencia
Clasificar la evidencia científica consiste en organizar la información disponible, en primer lugar, según el diseño de los estudios. Además hay que tener en cuenta que tan importantes como el diseño, o más, son los criterios de rigurosidad metodológica con los que se ha llevado a cabo el estudio.
Las escalas de clasificación de la evidencia científica diferencian de forma jerárquica los distintos niveles de dicha evidencia en función de su diseño. La gradación entre los distintos niveles de evidencia científica se basa en la capacidad de los diversos tipos de diseños para establecer relaciones causales.


Existen algunas escalas de clasificación de la evidencia científica. Quizás las más conocidas son las que elaboraron la Canadian Task Force en 1979 y posteriormente adoptada por la U.S Preventive Task Force. También es conocida la clasificación elaborada por The Swedish Council on Technology Assessment in Health Care (SBU). En general todas estas escalas son similares y utilizan como criterio de clasificación las características del diseño, pero no incorporan información acerca de la calidad o rigurosidad en la ejecución de los estudios. Cuando hay resultados contradictorios, estas condiciones de rigurosidad científica deberían permitir seleccionar el mejor estudio entre los de diseño similar o igual nivel de evidencia. En la Tabla 3, y a modo de ejemplo, se recogen los niveles de evidencia científica y el grado de las recomendaciones para la aplicabilidad clínica definidos por la Agency for Healthcare Research and Quality de los EEUU, donde las recomendaciones se clasifican en A (basadas en la evidencia científica), B (sugeridas por la evidencia científica) y C (basadas en la opinión de expertos). No obstante, lo importante no es la nomenclatura del grado de recomendaciones ni el número de niveles de evidencia científica, sino que exista una gradación.
Tabla 3. Niveles de evidencia científica y recomendaciones para la práctica clínica según la Agency for Healthcare Research and Quality

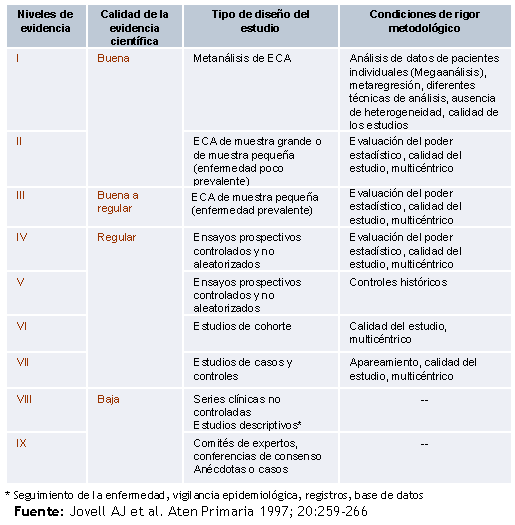
Se han elaborado propuestas de clasificación de la evidencia en las que también se incluye una valoración específica de la calidad de los estudios o condiciones de rigurosidad científica como la clasificación elaborada por la Agencia d’Avaluació de Tecnología i Recerca Mediques (AATRM) (verTabla 4). Estas condiciones de rigurosidad científica permiten seleccionar cuando hay resultados contradictorios, el mejor estudio entre los de diseño similar o igual nivel de evidencia. Por lo demás esta clasificación propuesta por la AATRM es similar a la de la Agency for Healthcare Research and Quality en considerar como primer nivel de calidad, el metaanálisis como el diseño de mayor rigor científico.

Tabla 4. Escala de clasificación de la evidencia científica de la AATRM
La clasificación de la evidencia científica en distintos niveles permite emitir recomendaciones acerca de la idoneidad de adoptar una tecnología sanitaria con mayor o menor énfasis según la evidencia científica que la respalda. Así, las recomendaciones se pueden clasificar en distintos grados según el nivel de evidencia científica (ver Tabla 5). Con ello se pretende que las recomendaciones o juicios de valor se hagan de forma explícita y maximizando la objetividad de la evidencia científica existente.
Tabla 5. Recomendaciones basadas en la escala de clasificación de la evidencia científica de la AATRM

Fuente: Jovell AJ et al. Aten Primaria 1997; 20:259-266
 Discusión y conclusiones
Discusión y conclusiones
En la valoración global de los resultados de la revisión sistemática deben tenerse en cuenta distintos factores tales como el número de estudios y su calidad, el grado de homogeneidad de los resultados, la robustez del análisis o la plausibilidad de los resultados.
